Überblick
NanoDSF steht für das Nano-Format der Differential Scanning Fluorimetry (DSF). Es ist eine schnelle, robuste, hochwertige und vor allem markierungsfreie Methode zur Analyse der Proteinstabilität, der thermischen Proteinentfaltung und der Schmelztemperatur. Infolgedessen ist nanoDSF ein hervorragendes Werkzeug für das Puffer- und Formulierungsscreening sowie das Screening von niedermolekularen Verbindungsbibliotheken auf Einfluss auf die Proteinstabilität und Verschiebungen der thermischen Schmelztemperatur. Zusätzlich ermöglicht nanoDSF die Analyse der Kolloidstabilität von Proteinlösungen (Aggregation).
Im Allgemeinen ist die intrinsische Tryptophanfluoreszenz von Proteinen stark von ihrer 3D-Struktur und damit der lokalen Umgebung der Tryptophanreste abhängig. Mit chemischen Denaturierungsmitteln oder einem thermischen Gradienten können Proteine ??entfaltet werden, was zu Veränderungen ihrer intrinsischen Tryptophanfluoreszenz führt. Dies führt zu Fluoreszenzemissionspeakverschiebungen und Intensitätsänderungen. NanoDSF überwacht diese Fluoreszenzänderungen mit hoher Zeitauflösung und kann sogar mehrfache Entfaltungsübergänge aufdecken. NanoDSF ist daher sehr erfolgreich in der Antikörperentwicklung, Membranproteincharakterisierung, Proteinqualitätskontrolle, Pufferscreening, Proteinentfaltungsanalyse und beim Screening der Bindung von niedermolekularen Verbindungen.
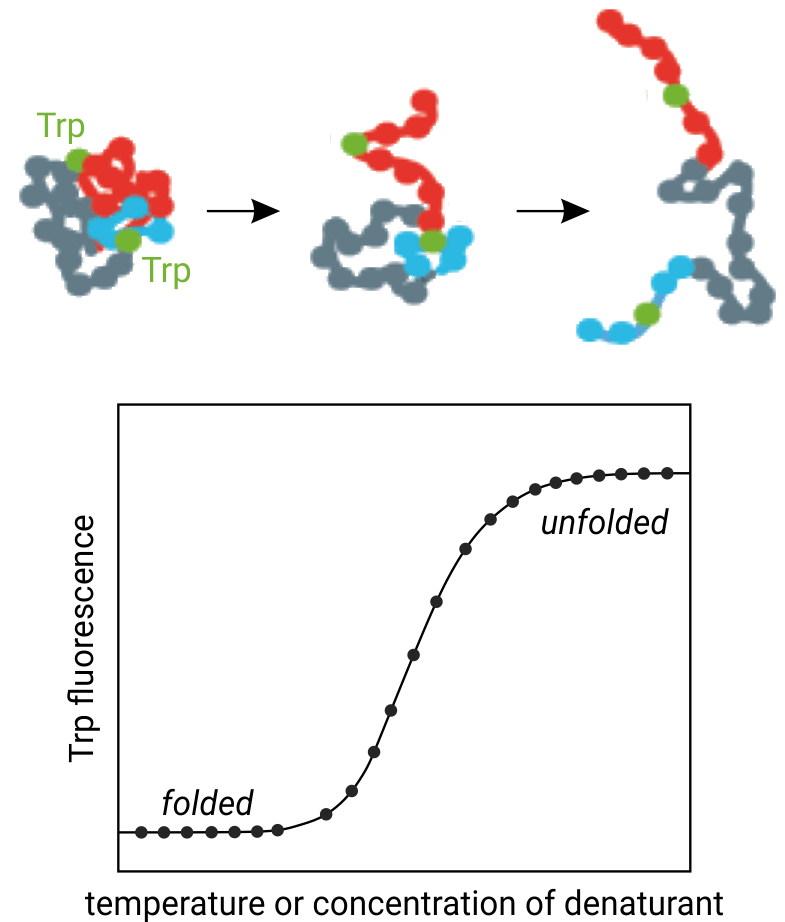
Die obige Abbildung zeigt das Prinzip der thermischen Proteinentfaltung: Bei steigender Temperatur entfaltet sich die dreidimensionale Proteinstruktur und Tryptophanreste werden dem Lösungsmittel ausgesetzt. NanoDSF überwacht die gleichzeitigen Änderungen der Tryptophanfluorenszenz bei Wellenlängen von 330 und 350 nm.
Um die Proteinaggregation zu erkennen, verfügt das nanoDSF-Gerät auch über eine Rückreflexionsoptik. Normalerweise passiert sichtbares Licht störungsfrei die Kapillaren mit der interessierenden Proteinprobe, wird von einem Spiegel auf der Kapillarschale reflektiert und schließlich vom Detektor quantifiziert. Wenn die Proteinprobe aggregierte Partikel enthält, wird das einfallende Licht von diesen Partikeln gestreut. Der Verlust der Reflektionsintensität ist ein genaues Maß für die Proteinaggregation.
Technologie
NanoDSF ist eine Differential-Scanning-Fluorimetrie-Methode zur Analyse der Konformationsstabilität und Kolloidstabilität (Aggregationsverhalten) von Proteinen unter verschiedenen thermischen und chemischen Bedingungen. Die Konformationsstabilität eines Proteins wird durch seinen Entfaltungsübergangspunkt Tm (° C) beschrieben, der der Punkt ist, an dem die Hälfte des Proteins entfaltet ist. Die wirklich markierungsfreie nanoDSF-Technik überwacht die intrinsische Tryptophanfluoreszenz von Proteinen, die für die nahe Umgebung der Tryptophanreste hochempfindlich ist und sich bei thermischer Entfaltung ändert.
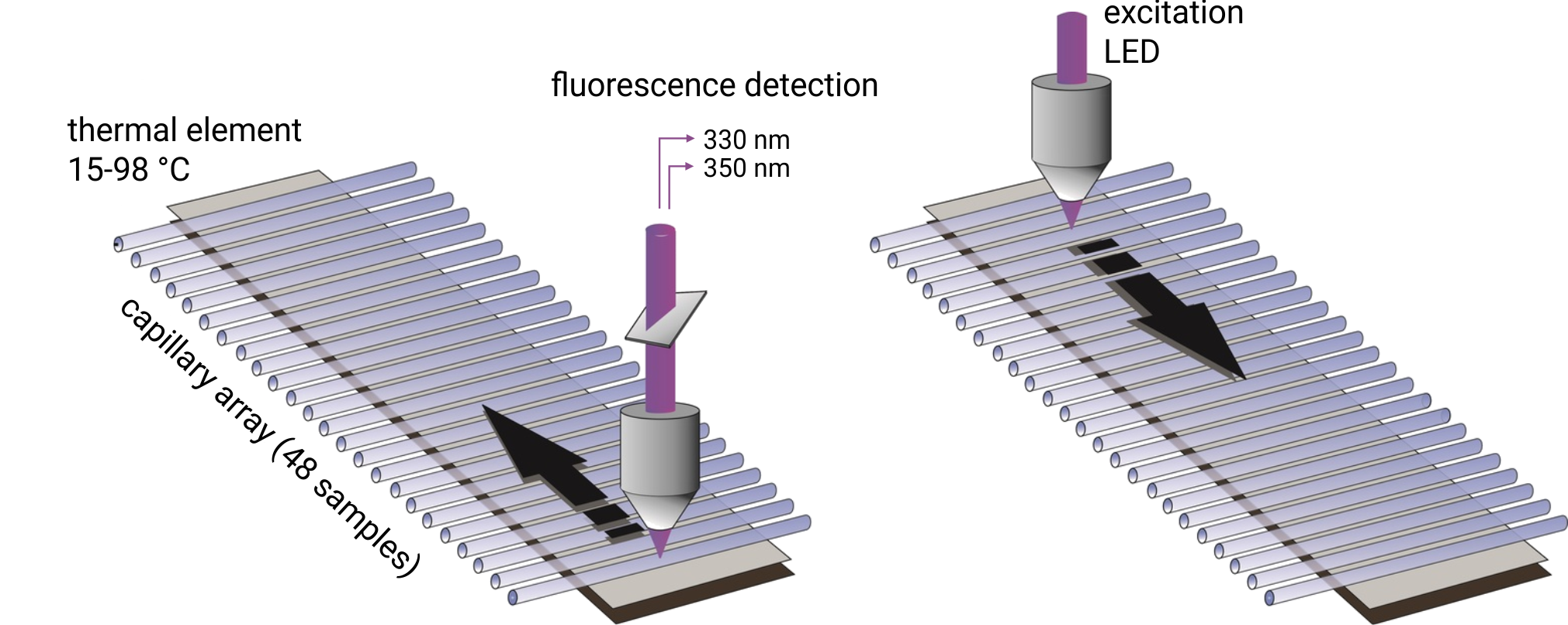
Bis zu 48 Kapillaren werden mit 10 µl Proteinprobe gefüllt und gleichzeitig bei Wellenlängen von 330/350 nm gescannt. Schmelztemperaturen werden durch Überwachen von Änderungen der intrinsischen Tryptophanfluoreszenz aufgezeichnet und die Temperaturen des Aggregationsbeginns werden durch Rückreflexionslichtstreuung erfasst. Die Proben können auf eine beliebige Temperatur im Bereich von 15 ° C bis 95 ° C erhitzt werden. Wichtig ist, dass die Proben ohne Farbstoff und mit frei wählbaren Puffern und Reinigungsmitteln untersucht werden können. Schmelztemperaturen von Proteinen mit einer Konzentration zwischen 5 µg / ml und 250 mg / ml können analysiert werden. Um eine hohe Qualität der Aggregationstemperaturen zu erreichen, sind Proteinlösungen mit Konzentrationen über 1 mg / ml erforderlich.
Typische Anwendungen
Aufgrund der robusten Erkennungsmethode und des schnellen Analysetempos ist nanoDSF sehr vielseitig und kann in einer Reihe von Zusammenhängen verwendet werden:
• Screening von Puffern, Formulierungen und Pufferadditiven
• Sieben von Reinigungsmitteln
• Analyse der thermischen und chemischen Proteinentfaltung
• Langzeitoptimierung der Protein- und Antikörperspeicherung
• Stabilitätsprüfung bei forciertem Abbau
• Vergleich von Biosimilar-Proteinen und -Antikörpern hinsichtlich Stabilität und Aggregation
• Batch-to-Batch-Vergleichstests
• Deep Feature Analyse (Einfluss von Mutationen, Modifikationen, Konjugationen auf Proteinstabilität und Aggregation)
Vorteile
• nanoDSF benötigt keine fluoreszierenden Farbstoffe wie Sypro Orange wie in Standard-DSF (Thermofluor)
• Geringer Probenverbrauch → Nur 10 µL Probe erforderlich
• Freie Wahl der Testpuffer → Additive / Detergenzien
• Sehr kurze Analysezeit → ermöglicht hohen Durchsatz
• Optimale Datenqualität und Auflösung → Dual 350/330 nm UV-Detektion
• Weiter Temperaturbereich → Analyse von 15 ° C bis 95 ° C möglich
• Keine Kennzeichnung erforderlich → Native Analyse möglich
• Breiter Konzentrationsbereich → 5 µg / ml bis 200 mg / ml
• Breiter Molekülgrößenbereich → Von 1 kDa bis 1 MDa